材料微生物阻隔性能评价方法
微生物屏障是无菌屏障系统在灭菌过程、搬运、运输、储存等测试条件下阻止微生物进入的性能。医疗器械常用的无菌屏障系统包括不透气和透气的材料。 不透气材料如塑料薄膜、塑料托盘、铝塑膜等。对于不透气材料,需要采用标准化的测试方法来确认该材料不透气,即满足微生物屏障性能要求。 标准ISO 11607-1附录C(GB/T 19633.1附录A)给出了不透气材料抵抗气体通过的测试方法。 对于透气材料(又称多孔材料)微生物阻隔性能的评价,目前国际上常用的测试方法有以下三种:ASTM F1608(YY/T 0681.10)透气包装材料微生物阻隔分级测试,ASTM F2638 (YY/T 0681.17) ) 使用气雾剂测试透气包装材料微生物阻隔性能的标准测试方法医疗器械产品包装设计公司,DIN 58953-6 (YY/T 0681.14) 灭菌医疗器械包装材料的微生物阻隔测试。

我国医药行业标准YY/T 0681.10《无菌医用包装试验方法第10部分:透气包装材料微生物阻隔分级试验》参考了ASTM F1608标准。 该标准使用枯草芽孢杆菌在干燥条件下进行测试,并测量透气无菌屏障材料防止细菌孢子渗透的能力。
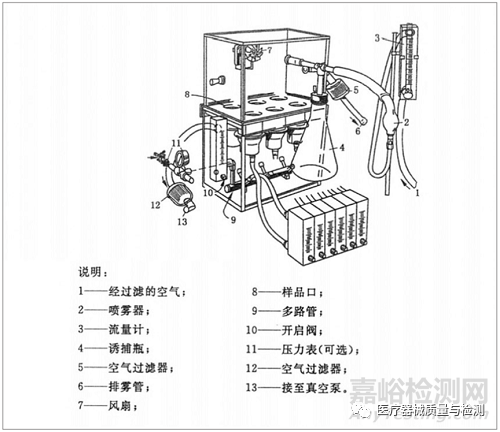

图1:测试室
完全不可渗透的对照样品(微生物零渗透)受到 100 万或 10^6 菌落形成单位 (cfu) 的挑战,cfu 10^6 数量的 log10 值为 6。 如果样品允许 10 cfu (log10=1) 渗透,则以与对照相同的方式进行攻击的样品的对数减少值 (LRV) 将为 5。 因此,LRV 越高,透气包装材料对微生物渗透的抵抗力就越强。 表1显示了LRV与相应孢子截获率之间的关系。 无菌屏障系统应尽可能选择LRV值较高的透气材料,以保证仪器的无菌保证水平,降低无菌失败的风险。 目前该方法能够被业界广泛接受,国内外开展该方法的实验室也相对较多。
该方法考虑了精度和偏差。 此信息基于 ASTM 1993 年进行的合作实验室研究。 十一个实验室各有一名操作员测试了从六种材料中随机选择的两个样品和一个阳性对照。 对所有混合材料的实验室内和实验室间变异的估计用于获得具有足够自由度的单操作员和多实验室精度估计。 另外,由于LRV的真实值未知,因此无法验证该方法的偏差,因此该方法的偏差未知。
我国医药行业标准YY/T 0681.17《无菌医用包装试验方法第17部分:透气包装材料气溶胶过滤法微生物阻隔试验》参考了ASTM F2638标准。 本标准采用1.0μm颗粒的气溶胶作为替代微生物来测定透气包装材料的阻隔性能。 它测量透气包装材料防止颗粒渗透的能力。 所有材料都具有出现最大渗透百分比 (%PMax) 的面速度。 渗透率越低,性能越好。 无菌屏障系统应尽可能选择%PMax值较低的透气材料,以保证器械的无菌保证水平,降低无菌失败的风险。 目前该方法已能被业界所接受,国内外开展该方法的实验室也在逐渐增多。

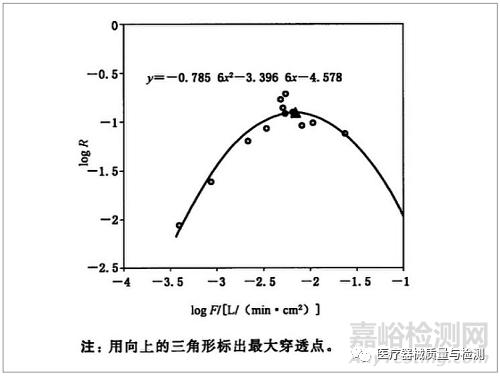
图 2:典型突破流量曲线
使用微生物测试透气包装材料的阻隔性能与测量材料的过滤效率相关。 该测试方法不需要使用微生物学方法,而是利用材料过滤颗粒的能力来评价材料的阻隔性能。 在测量透气包装材料的过滤效率时,可以获得典型的过滤效率曲线(见图2)。 特定材料的曲线曲率取决于材料本身。 最大穿透率可作为判断材料阻隔性能的重要依据。


图3:ASTM F2638测试设备
该方法的精度是基于美国测试与材料学会2004年对单计数器法的室内研究和2006年对双计数器法的补充研究。实验测试设备如图所示如图 3 所示。在 2012 年的研究中,2 个实验室分析了 6 个测试单元中的 4 种不同的透气包装材料。 两个独立的实验室内实验的结果证实了该方法在单计数器和双计数器配置中的重现性。 在研究时,没有合适的可接受的参考材料来确定该测试方法的偏差,因此没有给出偏差的描述。
我国医药行业标准YY/T 0681.14《无菌医疗器械包装试验方法第14部分:透气包装材料的干湿微生物阻隔试验》参考了DIN 58953-6标准。 本标准规定了潮湿条件和干燥条件下微生物屏障测试的试验方法。 湿态微生物屏障测试是在测试样品中添加微生物液滴。 液滴干燥后,进行测试以测试是否有微生物渗透到样本样品的另一面。 干燥条件微生物屏障测试是通过冷却与测试瓶密封的微生物屏障装置中的空气来进行的,气流将进入测试瓶。 如果包装材料在冷却前覆盖有微生物培养物,气流可能会导致含有微生物的颗粒穿过包装材料。 使用微生物技术记录和评估穿过包装材料的任何微生物。 该测试方法被设计为“通过、失败”类型测试。 该方法预设了一个验收标准,“如果所有10个测试样品的菌落生长不超过15个,并且任何1个测试样品的菌落生长不超过5个,则认为包装材料足以作为无菌屏障。” 目前,DIN 58953-6标准将包装材料阻隔性能的验收标准设定为“15和5”细菌菌落,没有任何理由和逻辑关系。
我国卫生部门发布的《消毒产品卫生安全评价规定》规定,进入医疗机构的带有灭菌标签的灭菌物品包装必须经过微生物屏障测试。 《消毒技术规范》规定了相应的测试方法和判定标准。 该方法与《消毒技术规范》中给出的测试方法和判断标准一致,可视为供应医疗机构消毒用透气材料的基本要求之一。

针对以上三种常见的测试方法,进行比较,说明每种测试方法的优缺点。 见下表2,点击放大。

材料微生物阻隔测试方法的讨论与建议
用于医疗器械灭菌的透气包装材料通常供应给医疗机构和医疗器械制造商。 由于两种情况的差异,如器械特性、灭菌方法、运输条件、储存条件和储存期限等,根据风险管理要求对材料的微生物阻隔性能提出了不同的要求。
DIN 58953-6(YY/T 0681.14)给出的试验方法与我国灭菌技术规范中按灭菌产品管理的灭菌物品包装的试验方法和验收标准一致。 该方法需要微生物学实验室预先设定验收标准,适合医疗机构和用户对灭菌透气包装材料的微生物阻隔性能进行初步检查和控制。 该方法无法为选择透气包装材料提供定量数据医疗器械产品包装设计公司,也无法评价透气包装材料的一致性。
对于医疗器械制造商来说,需要定量评估透气包装材料的微生物阻隔性能,以确定包装材料是否足以提供阻隔性能以应对各种挑战,例如灭菌过程、运输、搬运和储存过程。 挑战。 ASTM F1608(YY/T 0681.10)和ASTM F2638(YY/T 0681.17)给出的方法和结果为用户在无菌医疗器械的包装设计和包装验证方面提供帮助。 ASTM F2638(YY/T 0681.17)方法不需要微生物培养,模拟实际使用环境的挑战性条件,可以快速检测透气材料的微生物阻隔性能。 适用于医疗包装生产企业和包装用户对包装材料的日常控制。 比较与选择。 ASTM F1608(YY/T 0681.10)采用10^6 CFU/样品的微生物挑战体积和相对极端的挑战风速(2.8L/min)来评价包装材料的微生物阻隔性能。 这两种定量方法可以根据透气材料的阻隔性能对它们进行排名。 这两种方法没有给出验收标准。 对于医疗器械制造商来说,需要根据医疗器械的性能、临床应用、不同的灭菌工艺、运输条件和储存条件来确定验收标准。
概括
GB/T 19633.1中5.2.3规定“透气材料应能提供适当的微生物屏障,以提供无菌屏障系统的完整性和产品的安全性”。 YY/T 0681.10和YY/T 0681.17提供了测定透气包装材料微生物阻隔性能的定量微生物阻隔测试方法。 YY/T 0681.14在验收标准假设下定性评价透气材料的微生物阻隔性能。 在为医疗器械选择无菌屏障系统时,应考虑无菌屏障系统在产品使用前保持无菌的能力。 国内外监管机构越来越重视医疗器械的风险管理。 在设计和开发阶段,无菌屏障系统需要尽可能降低风险。 根据ISO 11607(GB/T 19633)的要求,必须通过包装验证选择具有足够的微生物屏障性能的无菌屏障系统。 包装材料。
医疗器械包装微生物阻隔性能测试方法探讨(摘录)