目的:选择适合方法对多种直接接触药品的包装材料微物理限度进行检测,并对方式的适用性进行验证。
方式:对固体药用聚丙烯瓶等数种药品包装材料依照相应药品包装材料国家标准和美国药典2015年版四部附录通则的规定进行微生物限度方式适用性验证。
结果:金褐色葡萄真菌、铜绿假单胞菌、枯草芽胞杆菌、白色念珠菌和黑曲霉五种标准菌株在菌落计数法验证实验中的回收率为60%~150%,符合药典规定。在控制菌的方式验证实验中,均可检出相应的实验菌。
结论:选定的方式适用于不同的药品包装材料的微生物限度检测
直接接触药品的包装材料及容器既具有了盛药品的功用,也由于其与药品的接触而或许影响药品的品质。微生物污染是药品包装容器可能给药品质量带来的风险之一,因此,为了保证药品的安全有效,必须严密控制包装容器的微物理污染程度。药品包装材料微物理限度检验主要是借助对附着在容器或材料表层的微物理进行收集和检测,而药品包装容器的材料组成成份、生产工艺、贮存条件等诸多原因都会对附着的微物理数量和类型带来影响。同时,检验方式中对样品表层附着微物理的收集方式——即供试液制备过程中涉及的提取介质及详细制备方式都可能对微生物产生一定的创伤从而妨碍微生物生长,可能给检测的确切性带给影响。微生物检测结果的确切性还得到其它多种原因的妨碍,如样本分布均匀性、样品溶液制各过程中微生物采集的有效性、检验方式的灵敏度等,这些内容通常尚未在标准方式中有具体的要求能够保证检测方式的科学性。但各个试验室仍需对标准方式在本试验室的适用性进行验证,从而确保本实验室的人员操作、实验环境、培养基和试剂等各个环节不会对该办法的结果导致影响,从而确保检查结果的精确性。
1仪器与材料
1.1仪器
生化培养箱815(赛默飞世尔);高压蒸汽灭菌锅MLS一3780(中国三洋公司);ESCO生物安全柜ClassIIBSC(艺思高技术有限公司)。
1.2实验用标准菌株
化学梅里埃定量质控菌株550系列,包括金橙色葡萄球菌(,S.)NCTC10788(批号:B3651)、铜绿假单胞菌(,P.)NCTC12924(批号:B3653)、枯草芽孢杆菌(,B.sub)NCTC10400(批号:B3647)、白色念珠菌(,C.)NCPF3179(批号:B3663)、黑曲霉(niger,A.niger)NCPF2275(批号:B3642)、大肠埃希菌(cob,E.coli)(批号:B3661)。
1.3培养基及试剂
胰酪大豆胨琼脂培养基(TSA)干粉、胰酪大豆胨液态培养基(TSB)干粉、沙氏葡萄糖琼脂培养基(SDA)干粉、麦康凯液体培养基干粉、麦康凯琼脂培养基干粉、溴化十六羰基三甲铵琼脂培养基干粉、甘露醇氯化钠琼脂培养基干粉,均来自于上海中科昆虫生物科技研发有限公司。上述培养基适合性检测符合要求。
1.4实验样品
本实验所用样品均为日常测试样品。
1.5菌液的制备
将不同类型的550标准菌株球分别倒入1.1ml14d复溶液中,混匀,为试验用菌液(即500cfu/ml标准菌株实验用菌液)。
1.6供试液及滤膜的合成
1.6.1垫片、膜、药用瓶、铝管等
药用聚酯/铝/聚丙烯封口垫片、外用贴膏剂用涤纶非织造布及复合膜、口服固体食用瓶、铝管及胶囊管分别按国家药包材标准中—2015、2015、—2015、—2015微生物检测项下的规定进行供试液制备后,分别取非常于技术标准中的一个单位(一片垫片、100-2cm的复合膜、一个瓶、一支铝管)的供试液进行薄膜过滤。
1.6.2气雾剂阀门
取样品10个,置于锥形瓶中,加入硫酸钠注射液100ml,振摇1min,即得1:10供试液。取供试品溶液10ml进行薄膜过滤。
1.6.3口服固体药用瓶盖
取本品10个,将无菌棉签用硫酸钠注射液盖住,在瓶子内侧擦拭,然后立刻切断后将棉签投入盛有100ml氯化钠注射液的锥形瓶中药品包装材料的分类,换1支棉签,同法操作(即每个瓶盖用2支棉签擦拭)。将瓶迅速摇晃1min,即得1:10供试品溶液。分别取供试品溶液10ml进行薄膜过滤。
1.6.4滤膜的冲洗
每张滤膜冲洗3次,每次的清洗液体积为50ml。取滤膜照中国药典2015年版四部通则l105进行需氧菌总数、霉菌及酵母总数检查,照中国药典2015年版四部通则1106进行控制菌检测。
1.6.5菌落计数和控制菌检测
需氧菌、酵母及霉菌菌落计数及控制菌E.coli、和P.检验均按文献操作。
1.7方法适用性验证
需氧菌、霉菌及酵母总数计数及控制菌方法适刖性验证实验依据文献操作。加入的标准要求菌种量为50cfu,即上述1.5中的菌液0.1ml。回收率(%)=(试验组菌数-供试品对照组菌数)/菌液对照组菌数×100%。当5种标准菌的回收率均为50%~200%时,判定为合格。
2结果
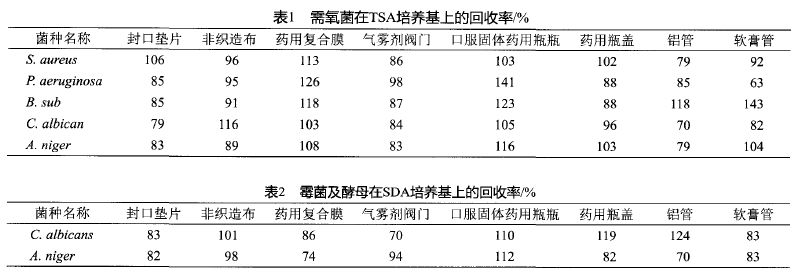
对8种药品包装材料的微物理限度试验中的厌氧菌、霉菌及酵母的方式适用性验证结果显示,标准菌株的回收率均为63%~143%(表1~2);在控制菌的验证实验中,大肠埃希菌的实验组和菌液对照组在封口垫片、药用复合膜、气雾剂阀门、口服固体食用瓶及入药瓶盖包装材料上的实验结果均是阳性,而供试品对照组则为阳性;金褐色葡萄真菌和铜绿假单胞菌的实验组和菌液对照组在非织造布、气雾剂阀门、药用复合膜、铝管和软膏管上的实验结果均是阳性,而供试品对照组则为阳性。这些结果证实,这三种控制菌的方式适用性验证结果均依照药典相关规定,而8种药品包装材料的微物理限度试验方式也均适用。
3讨论
本实验对直接接触药品的包装容器及材料中的封口垫片、非织造布、复合膜、气雾剂阀门、口服固体食用瓶、瓶盖、软膏管、铝管8个产品的检测方式进行了适用性验证。在菌落计数法中,金褐色葡萄真菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉5种标准菌株回收率均为63%~143%,符合2015年版《中国药典》四部通则1105中50%~200%的要求。大肠埃希菌、金褐色葡萄真菌及铜绿假单胞菌的控制菌方法适用性验证也均依照2015年版《中国药典》四部通则1106的规定。
对不同的药品包装材料的产品,应选用适合正确的检测方式,并对所选的方式进行适用性验证,只有当手段适用性验证结果依照规定时,才能证明所采用的方式标准是合理的,检测该类产品的结果是具体有效的。但在标准中针对同类品种不同制造企业生产时能否进行方式适用性的验证未作确立规定,有待日后进一步加强。
小编注
本文来自上海药包材测试所朱莲花。
END
免责声明:上述内容仅供交流学习使用,对文中陈述、观点判断保持中立药品包装材料的分类,不对所包括内容的确切性、可靠性或完整性提供任何明示或暗示的确保。仅作参考,并请大家自行承担全部责任。版权归原作者所有,如遇版权问题请联系小编删除。
你的点的每一个漂亮,我都认真当成了喜欢